
主备人:王海富 通讯稿撰写:徐守兵
2017年11月28日上午,高二化学备课组(小高考)的老师们聚集在汇贤楼二楼接待室,开展了本学期第12次集体备课活动。
活动中,主备王海富主任认为,对照小高考考试说明,硫及其化合物知识的复习内容要从五个方面展开,并具体就每一个方面进行了细致的分析,备课组的其他老师不时进行了补充和讨论。王主任提醒大家,在准备小高考复习时要注重课本,对教材中的一些重要实验细节也要多加关注。
最后备课组长戴建良老师就本次备课活动进行了总结。戴建良、赵永承、朱旭文、陈益、徐守兵、王海富、陈文婷老师参加了本次备课活动。
附:本次活动的照片



附2:第十一讲 硫及其化合物
王海富
| 测试内容 | 测试要求 |
|
|
| 1. 了解硫及其重要化合物的主要物理性质。 | B |
|
|
| 2. 知道硫单质的主要用途。 | B |
| Ⅰ |
| 3. 了解二氧化硫与氧气、与水的反应,认识亚硫酸的不稳定性,认识二氧化硫的漂白作用与次氯酸漂白的区别。 | B |
|
|
| 4. 了解浓硫酸的强氧化性;了解浓硫酸分别与铜、木炭的反应;了解常温下铁、铝在浓硫酸中的钝化现象。认识工业上生产硫酸的反应原理。 | B |
|
|
| 5. 了解二氧化硫等污染物的来源、性质和危害,认识非金属及其重要化合物对生态环境的影响,初步形成可持续发展的思想。 | B |
| Ⅱ |
![]()
1. 硫
(1) 硫的存在:游离态——硫黄,化合态——黄铜矿、硫铁矿、石膏、芒硝等。
(2) 硫的物理性质:________色晶体,质脆,易研成________。________溶于水,________ 溶于酒精,________溶于二硫化碳。
(3) 硫与氧气的反应:______________。
2. 二氧化硫
物理性质:________色有________气味的________气体,密度比空气________,易________,________溶于水。
化学性质:
(1) 酸性氧化物。
①SO2与水反应:__________________________。
②与碱性氧化物(CaO)反应:________________(除去燃煤中的SO2)。
③与碱(如与NaOH)反应:______________(SO2少量);__________________(SO2过量)。
④与盐(如与NaHCO3)反应:2NaHCO3+SO2===Na2SO3+H2O+2CO2 (SO2少量),
NaHCO3+SO2===NaHSO3+CO2 (SO2过量)。
(2) 既有氧化性又有还原性。
①SO2被催化氧化为SO3:________________________。
②SO2和H2S反应:SO2+2H2S===3S↓+2H2O
(3) SO2的漂白性。
二氧化硫具有漂白作用,能够与________等有色物质结合生成一种不稳定的无色物质,但在光照或受热的条件下又能变为原来的颜色。
3. 三氧化硫
与水反应:__________________________。
与碱反应:__________________________。
4. 浓硫酸
(1) 物理性质:无色透明油状液体,通常质量分数为________,密度为1.84g/cm3。
(2) 化学特性:a.________性;b.________性; c.________性。________、________在浓H2SO4中“钝化”,浓H2SO 4表现了________。
浓硫酸与铜反应:______________________________________。
浓硫酸与碳反应:______________________________________。
![]()
1. SO2的漂白性原理:与品红等结合生成不稳定的无色物质,这种无色物质加热又分解成原来的物质。
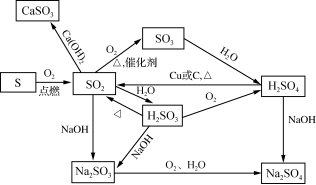
2. 硫及其化合物之间的转化关系。
3. 二氧化硫能使氯水(溴水、碘水)、三价铁盐溶液、酸性高锰酸钾溶液褪色。有关反应为SO2+Cl2+2H2O===4H++2Cl-+SO![]() ;SO2+2Fe3++2H2O===SO
;SO2+2Fe3++2H2O===SO![]() +2Fe2++4H+;5SO2+2MnO
+2Fe2++4H+;5SO2+2MnO![]() +2H2O===5SO
+2H2O===5SO![]() +2Mn2++4H+。
+2Mn2++4H+。
在这些反应中,二氧化硫表现还原性,而非漂白性。
![]()
【例1】(2017届盐城中学模拟)具有漂白作用的物质:①氯气;②二氧化硫;③活性炭;④过氧化钠。其中漂白原理相同的是( )
A. ①③ B. ②③ C. ①④ D. ②④
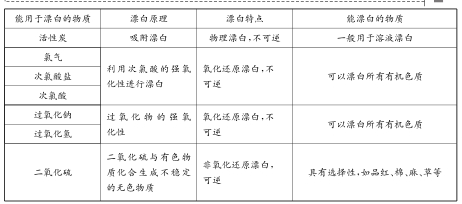
解析:使物质褪色的原理有三种:一种是利用物质的吸附性,将有色物质吸附掉;一种是利用物质的强氧化性,将有色物质的显色基团氧化掉;另一种是与有色物质化合生成一种无色物质。
答案:C
点拨导引:物质漂白性的比较
【例2】 (2017届常州中学模拟) 下列对浓硫酸的叙述中,正确的是( )
A. 常温下不能用铁、铝容器盛放浓硫酸,因为铁、铝是活泼金属
B. 浓硫酸具有吸水性,可以使蔗糖炭化
C. 浓硫酸和Na2SO3反应制取SO2时,浓硫酸表现出强氧化性
D. 浓硫酸和铜片加热反应,既表现了酸性,又表现出强氧化性
解析:浓硫酸的特性要与具体实例相联系。常温下,浓硫酸能使铁、铝表面形成致密的氧化膜而钝化,保护了内层金属不跟浓硫酸反应,故可以用铁、铝容器盛放浓硫酸,A项错误;浓硫酸具有脱水性,能使蔗糖炭化,B项错误;Na2SO3+H2SO4(浓)![]() Na2SO4+SO2↑+H2O,无价态变化,属于复分解反应,C项错误;Cu+2H2SO4(浓)
Na2SO4+SO2↑+H2O,无价态变化,属于复分解反应,C项错误;Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,只有一半硫酸被还原,另一半硫酸体现酸性,D项正确。
CuSO4+SO2↑+2H2O,只有一半硫酸被还原,另一半硫酸体现酸性,D项正确。
答案:D
点拨导引:浓硫酸吸水是把物质本身中自由的水分子或结晶水吸收。浓硫酸脱水是把本身不含水的有机物中的氢元素和氧元素按原子个数比2¡Ã1的形式脱去。所以,二者的本质区别是物质中是否有现成的水分子。
![]()
1. (2014年江苏省普通高中学业水平测试)浓硫酸不具有的性质是( )
A. 吸水性 B. 腐蚀性 C. 强氧化性 D.易挥发性
2. (2013年江苏省普通高中学业水平测试)化学与生活密切相关。下列生活中常见物质的 俗名与化学式相对应的是( )
A. 苏打——NaHCO3 B. 胆矾——CuSO4
C. 酒精——C2H5OH D. 生石灰——Ca(OH)2
3. (2009年江苏省普通高中学业水平测试)下列物质与水反应生成强酸的是( )
A. Na2O B. SO3 C. CO2 D. NH3
4. (2008年江苏省普通高中学业水平测试)某气体通入品红溶液中,溶液褪色,加热后又恢复为原来颜色,该气体是( )
A. SO2 B.O2 C. CO2 D. H2
5. (2007年江苏省普通高中学业水平测试)下列气体中不能用浓硫酸干燥的是( )
A. O2 B. CO2 C. NH3 D. SO2
6. (2007年江苏省普通高中学业水平测试)下列化学反应中,H2SO4作为氧化剂的是 ( )
A. 2NaOH+H2SO4===Na2SO4+2H2O
B. C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
C. BaCl2+H2SO4===BaSO4↓+2HCl
D. CuO+H2SO4===CuSO4+H2O
![]()
1. (2017届连云港学测模拟)下列物质溶于水所得溶液呈酸性的是( )
A.NH3 B.NaCl C. NaHCO3 D. SO2
2. (2017届宿迁学测第二次模拟)下列气体能使品红溶液褪色的是( )
A. SO2 B. O2 C. NH3 D. HCl
3. (2017届南京学测模拟)下列不能与浓H2SO4反应的物质是( )
A.Cu B.C C. Na2CO3 D. SiO2
4. (2017届连云港学测模拟)下列关于SO2性质的说法不正确的是( )
A. 能形成酸雨 B. 能使鲜花褪色
C. 是无色无味的气体 D. 能与NaOH溶液反应
5. (2017届南通学测第一次模拟)下列关于浓H2SO4的说法正确的是( )
A. 是一种无色粘稠状的液体 B. 常温下使Cu发生钝化
C. 使蔗糖变黑体现其吸水性 D. 可用于干燥氨气
6. (2017届镇江学测模拟)下列有关物质应用的叙述中,错误的是( )
A. Si用于制造光导纤维
B. 过氧化钠可用作潜艇供氧剂
C. 水玻璃浸泡过的木材既能防腐又能耐火
D. 常温下,铁槽、铝槽可存放冷的浓硝酸、浓硫酸
7. (2017届南通一中模拟)飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不宜沉降,它与空气中SO2、O2接触时,SO2会部分转化为SO3 ,使空气的酸度增加,飘尘所起的作用可能是( )
①氧化剂②还原剂 ③催化剂 ④吸附剂
A. ①② B. ②③
C. ①②③ D. ③④
8. (2017届徐州市第一次模拟)下列气体中,无色但有刺激性气味的是( )
A. Cl2 B. SO2
C. N2 D. NO2
9. (2017届扬州市学测二)下列关于物质性质的说法正确的是( )
A. 通常状况下,NO2是无色的气体
B. SO2能漂白品红等物质,说明SO2有氧化性
C. 加热时,铁单质与浓硝酸不发生反应
D. 二氧化氯具有强氧化性,可用于自来水的杀菌消毒
10. (2017届镇江中学模拟)(1) 浓硫酸与木炭在加热条件下的化学方程式为__________ 。
(2) 试用下列各装置设计一个实验,验证上述反应所产生的各种产物。 这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号):______→______→______→______。
(3) 实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是______________,B瓶溶液的作用是____________,C瓶溶液的作用是__________________。
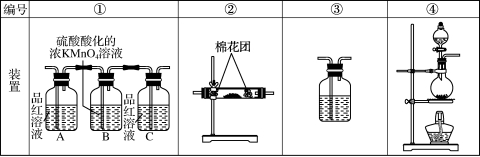
(4) 装置②中所加的固体药品是________,可确定的产物是________,确定装置②在整套装置中位置的理由是__________________________________________________________。
(5) 装置③中所盛溶液是________,可验证的产物是________。