
主备人:徐守兵 通讯稿撰写:赵永承
2017年10月24日上午,高二化学备课组(小高考)的老师们聚集在学生接待室,开展了本学期第8次集体备课活动。
活动中,备课组长戴建良老师首先向大家再次明确了本学期的进度要求和期中考试的范围:按照之前的要求,每种金属或非金属的专题用时3课时即一周,故本周应该完成铁及其化合物的内容。期中考试主要围绕金属的内容,非金属部分不涉及难题。
接下来开始进行针教学内容进行备课。徐守兵老师主备了“氯及其化合物”一单元的内容。按照上一次集体备课时提出的要求,徐老师对此次备课活动做了精心的准备:将历年江苏学业水平考试真题中考到的相关知识点汇总后分发至每位参与备课的老师,并逐题进行说明,同时,也将配套材料中出现的一些有歧义或错误的地方提出,比如,验证氯水有酸性,用方程式CaCO3+2H+ = Ca2++H2O+CO2↑来表示就不是太好,等等。大家也积极地参与讨论。
戴建良、赵永承、朱旭文、陈益、徐守兵、王海富、陈文婷老师参加了本次备课活动。
附:本次活动的照片


第十讲 氯及其化合物
徐守兵
![]()
| 测试内容 | 测试要求 |
|
|
| 1. 了解氯及其重要化合物的主要物理性质。 | B |
|
|
| 2. 知道氯单质的主要用途。 | B |
| Ⅰ |
| 3.了解氯气的氧化性(与氢气、钠、铁、某些盐等的反应)及其与水、碱的反应。 | B |
|
|
| 4.知道氯水的消毒和漂白原理。 | A |
|
|
| 5.了解次氯酸的强氧化性。 | B |
|
|
![]()
一、氯气
1.物理性质
________色,有________气味的气体,密度________空气,有________,易________。
2.化学性质
(1) 与金属钠、铁、铜反应:
________________________________________。
________________________________________。
________________________________________。
(2) 与非金属(氢气)反应:________________________________________。
(3) 与化合物反应:
与水反应________________________________________。
制漂白液的反应____________________________________。
制漂白粉的反应____________________________________。
二、次氯酸
1.次氯酸有________性,能杀菌消毒,具有________作用。
2.次氯酸是一种很弱的酸,酸性比碳酸还弱。
3.次氯酸不稳定,只存在于水中,见光会分解,化学方程式为______________________。
三、氯离子的检验
主要试剂有________________________________。
![]()
1. 氯水
氯气的水溶液称为氯水,溶液中部分Cl2与水发生反应:Cl2+H2OHCl+HClO。
新制的氯水因含次氯酸而有消毒、杀菌及漂白作用。次氯酸是弱酸,不稳定,光照容易分解。新制氯水可以表现出多重性质,如下表:
| 加入物质 | 实验现象 | 反应的化学方程式解释 | 起作用成分 | 表现的性质 |
| FeCl2溶液 | 溶液变黄色 | 2FeCl2+Cl2===2FeCl3 | Cl2 | 强氧化性 |
| 紫色石蕊试液 | 溶液先变 红后褪色 | | H+ HClO | 酸性 漂白性 |
| 湿润的红布 | 红色褪去 | 将红色色素氧化成无色 | HClO | 漂白性 |
| 加入CaCO3 | 有气泡产生 | CaCO3+2H+===Ca2++CO2↑+H2O | HCl | 酸性 |
| 加入AgNO3 | 有白色沉淀 | Ag++Cl-=== AgCl↓ | Cl- | Ag+的沉淀剂 |
2. 实验室氯气的制备:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
3. 漂白粉主要是CaCl2和Ca(ClO)2的混合物,其中有效成分是Ca(ClO)2。其漂白原理可表示为Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO。
4. 卤素单质的互相转化
Cl2+2NaBr===2NaCl+Br2 Cl2+2KI===I2+2KCl Br2 +2KI===I2 +2KBr
5. 氯及其化合物之间的转化关系
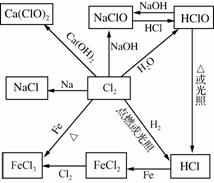
![]()
【例1】 (2017届南师附中模拟)下列检验Cl-的方法中,正确的是( )
A. 在某溶液中滴加AgNO3溶液,若产生白色沉淀,说明该溶液中有Cl-
B. 在某溶液中先滴加盐酸,再滴加AgNO3溶液,若产生白色沉淀,说明溶液中有Cl-
C. 在某溶液中先滴加AgNO3溶液,产生白色沉淀,再滴加盐酸,沉淀不消失,说明溶液中有Cl-
D. 把某溶液先用稀HNO3酸化,再滴入AgNO3溶液,若产生白色沉淀,说明溶液中有Cl-
解析:A项中不能排除CO![]() 、SO
、SO![]() 等离子的干扰。B项中先加入盐酸也就是先加入了Cl-,再加Ag+一定有白色沉淀生成,但不知是原溶液中是否存在Cl-。C项错在“再加盐酸”,再加盐酸还是会和AgNO3产生白色沉淀,若用稀HNO3就可以了。D项中用的方法能排除SiO
等离子的干扰。B项中先加入盐酸也就是先加入了Cl-,再加Ag+一定有白色沉淀生成,但不知是原溶液中是否存在Cl-。C项错在“再加盐酸”,再加盐酸还是会和AgNO3产生白色沉淀,若用稀HNO3就可以了。D项中用的方法能排除SiO![]() 、CO
、CO![]() 等离子的干扰,是正确的检验Cl-的方法。
等离子的干扰,是正确的检验Cl-的方法。
答案:D
点拨导引:①若某溶液中滴加稀硝酸可产生白色沉淀,则该溶液中可能含有SiO![]() 和AlO
和AlO![]() ;若加入过量稀硝酸可产生白色沉淀,则该溶液中含有SiO
;若加入过量稀硝酸可产生白色沉淀,则该溶液中含有SiO![]() 。
。
②某溶液中加入AgNO3溶液若产生白色沉淀,则该溶液中可能含有Cl-、CO![]() 、OH-;若白色沉淀不溶于稀硝酸,则该溶液中含有Cl-。
、OH-;若白色沉淀不溶于稀硝酸,则该溶液中含有Cl-。
【例2】(2017届南京市金陵中学模拟)NaCl是一种化工原料,可以制备一系列物质(见右下图)。下列说法正确的是( )
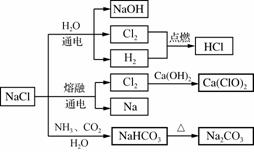
A. 25℃时,NaHCO3在水中的溶解度比Na2CO3的大
B. 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C. 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D. 图所示转化反应都是氧化还原反应
解析:25℃,NaHCO3在水中的溶解度比Na2CO3的要小,A错;石灰乳与Cl2的反应中氯发生歧化反应,Cl2既是氧化剂,又是还原剂,B正确;常温下干燥的Cl2能用钢瓶贮存仅代表常温下Cl2与铁不反应,但加热、高温时可以反应,C错;在侯氏制碱法中不涉及氧化还原反应,D错。
答案:B
点拨导引:侯氏制碱法第一步反应为NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl。
![]()
1. (2015年江苏省普通高中学业水平测试)漂白粉的有效成分是( )
A. Ca(ClO)2 B. CaCl2 C. Ca(OH)2 D. CaCO3
2. (2015年江苏省普通高中学业水平测试)下列关于Cl2性质的说法正确的是( )
A. 密度比空气小 B. 是无色无味的气体
C. 能使干燥的有色布条褪色 D. 可与NaOH溶液反应
3. (2013年江苏省普通高中学业水平测试)下列物质属于纯净物的是( )
A. 玻璃 B. 蒸馏水 C. 漂白粉 D. 空气
4. (2008年江苏省普通高中学业水平测试)下列物质中含有自由移动Cl-的是( )
A. KClO3固体 B. Cl2 C. HCl气体 D. KCl溶液
5. (2010年江苏省普通高中学业水平测试)某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。已知:①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2;②氯气和碱的反应为放热反应。温度较高时,氯气和碱还能发生如下反应:
3Cl2+6OH-![]() 5Cl-+ClO
5Cl-+ClO![]() +3H2O
+3H2O
该兴趣小组设计了下列实验装置,进行实验。
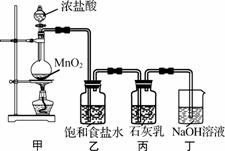
请回答下列问题:
(1) ①甲装置用于制备氯气,乙装置的作用是____________________________________。
②该兴趣小组用100mL12mol/L盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石 灰乳反应,则理论上最多可制得Ca(ClO)2________g。
(2) 小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,其可能原因是部分氯气未与石灰乳反应而逸出,以及温度升高。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢匀速地通入足量氯气,得出了ClO-、ClO![]() 两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。
两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。
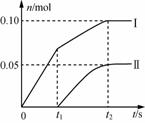
①图中曲线Ⅰ表示________(填离子符号)的物质的量随反应时间变化的关系;
②所取石灰乳中含有Ca(OH)2的物质的量为________mol;
③另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.37mol,则产物中 ![]() =________。
=________。
(3) 为了提高Ca(ClO)2的产率,可对丙装置作适当改进。请你给出一种改进方法:__________________________。